製造販売後調査・副作用報告・感染症報告の手続き
製造販売後調査(使用成績調査・特定使用成績調査)の手続き
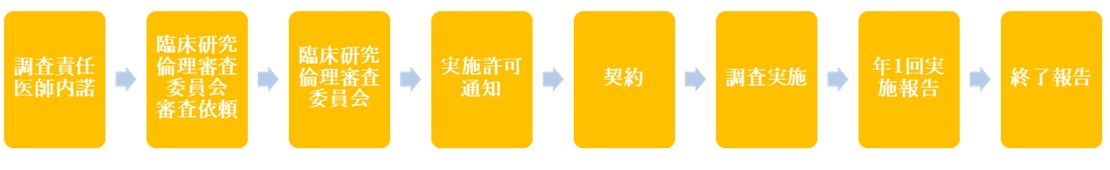
新規申請
①診療科の調査責任医師へ調査実施について打診
②調査責任医師の内諾を得る(調査計画・契約内容の説明と合意)
③製販後調査等新規申請手続き
臨床研究倫理審査委員会にて審査を行うため、下記書類を臨床研究管理室へ提出
臨床研究管理室にて、提出書類の事前確認・ヒアリング(不明点・相談等がありましたら、
②終了後、臨床研究管理室へお問い合わせください。)
②調査責任医師の内諾を得る(調査計画・契約内容の説明と合意)
③製販後調査等新規申請手続き
臨床研究倫理審査委員会にて審査を行うため、下記書類を臨床研究管理室へ提出
臨床研究管理室にて、提出書類の事前確認・ヒアリング(不明点・相談等がありましたら、
②終了後、臨床研究管理室へお問い合わせください。)
【必要申請書類】
(A)調査実施計画書または実施要綱(6部)
(B)登録票・調査票の見本(6部)
(C)薬剤・機器 添付文書(6部)
(D)パンフレット(6部)
(E)同意説明文書(必要時)
【契約について】
契約書案(当院書式ではなくても可。下記注意事項に沿って作成)のドラフト版を事前に臨床研究倫理審査委員会事務局(rinshokenkyu@chutoen-hp.shizuoka.jp)宛てにメールにて提出してください。
※契約書作成時の注意事項
・契約機関 :掛川市・袋井市病院企業団
・契約者 :掛川市・袋井市病院企業団 企業長 宮地正彦
・調査責任医師:掛川市・袋井市病院企業団立中東遠総合医療センター
(例)●●科 中東遠花子
・分担医師名について契約書へ記載しない(状況により対応します)
・管理料:調査費用の30%(状況により対応します)
④臨床研究倫理審査委員会開催後、結果を通知
⑤契約:事前に固定した契約書に押印したものを2部(もしくは3部)提出
⑥契約締結後調査開始
(A)調査実施計画書または実施要綱(6部)
(B)登録票・調査票の見本(6部)
(C)薬剤・機器 添付文書(6部)
(D)パンフレット(6部)
(E)同意説明文書(必要時)
【契約について】
契約書案(当院書式ではなくても可。下記注意事項に沿って作成)のドラフト版を事前に臨床研究倫理審査委員会事務局(rinshokenkyu@chutoen-hp.shizuoka.jp)宛てにメールにて提出してください。
※契約書作成時の注意事項
・契約機関 :掛川市・袋井市病院企業団
・契約者 :掛川市・袋井市病院企業団 企業長 宮地正彦
・調査責任医師:掛川市・袋井市病院企業団立中東遠総合医療センター
(例)●●科 中東遠花子
・分担医師名について契約書へ記載しない(状況により対応します)
・管理料:調査費用の30%(状況により対応します)
④臨床研究倫理審査委員会開催後、結果を通知
⑤契約:事前に固定した契約書に押印したものを2部(もしくは3部)提出
⑥契約締結後調査開始
各種変更手続き
下記書類を臨床研究管理室へ提出してください。
【必要書類】
(A)変更箇所一覧
(B)変更契約書(案)変更覚書(案)
(C)その他(変更内容に応じて)
※医師の所属変更については、こちらで対応します。
【必要書類】
(A)変更箇所一覧
(B)変更契約書(案)変更覚書(案)
(C)その他(変更内容に応じて)
※医師の所属変更については、こちらで対応します。
実施状況報告
- 年に一度全ての調査において実施状況報告(1月~12月の1年間の状況)を提出。
- 3月の臨床研究倫理審査委員会で報告
※10月末までに契約締結した全ての調査が対象
※3月末までに調査終了となる場合は不要
→ただし、終了後速やかに終了報告を提出
【必要書類】
調査終了(中止・中断)報告
- 調査終了(中止・中断)後、速やかに終了報告書を提出してください。
【必要書類】
支払い
- 支払いは年単位でお願いいたします。
- 実施状況報告書提出(1月末締切)後、実施件数、契約書に基づき請求書を送付します。
- 請求書記載の当院指定口座への振り込みをお願いいたします。
副作用・感染症報告の手続き

①調査責任医師の内諾を得る(調査計画・契約内容の説明と合意)
②副作用・感染症報告等実施申請手続き
【必要書類】
(A)契約書案(書式不問。下記注意事項に沿って作成)
(B)調査票
※A・Bに関しては事前に臨床研究倫理審査委員会事務局(rinshokenkyu@chutoen-hp.shizuoka.jp)宛てにメールにて提出
※契約書作成時の注意事項
②副作用・感染症報告等実施申請手続き
【必要書類】
(A)契約書案(書式不問。下記注意事項に沿って作成)
(B)調査票
※A・Bに関しては事前に臨床研究倫理審査委員会事務局(rinshokenkyu@chutoen-hp.shizuoka.jp)宛てにメールにて提出
※契約書作成時の注意事項
- 契約機関 :掛川市・袋井市病院企業団
- 契約者 :掛川市・袋井市病院企業団 企業長 宮地正彦
- 調査責任医師:掛川市・袋井市病院企業団立中東遠総合医療センター
- (例)●●科 中東遠花子
- 分担医師名について契約書へ記載しない(状況により対応します)
- 管理料:調査費用の30%


